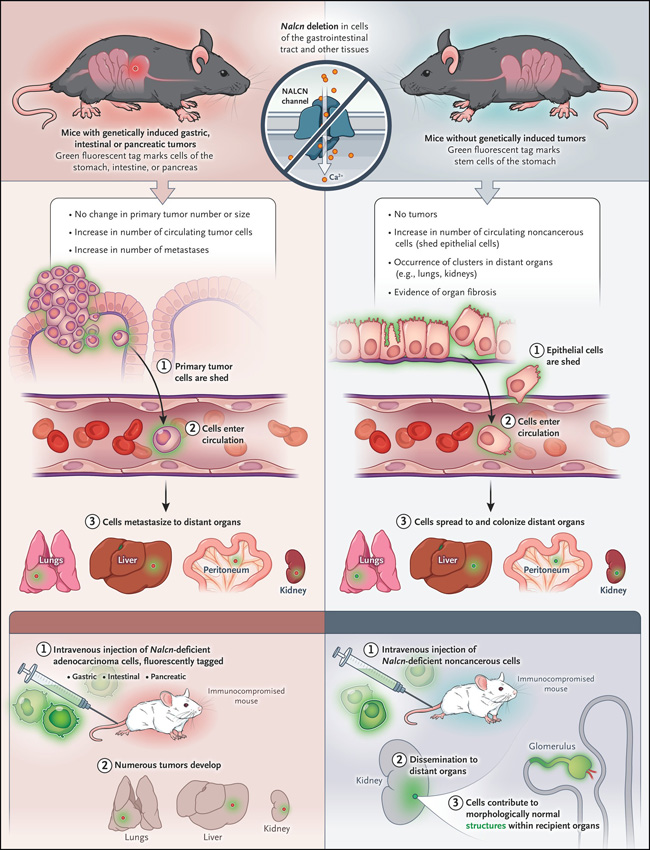
Il cancro progredisce attraverso una stretta sequenza di eventi: le mutazioni oncogeniche nelle cellule normali portano a un’eccessiva proliferazione e all’inizio del tumore, seguite dall’invasione attraverso la membrana basale, dalla diffusione attraverso il sistema linfatico e infine dalla colonizzazione metastatica di organi distanti. Un presupposto riguardo a questa cascata dall’invasione alla metastasi è che sia una proprietà esclusiva delle cellule che hanno acquisito mutazioni oncogeniche. Rahman e colleghi sfidano questo dogma, fornendo la prova che le cellule epiteliali non trasformate prive di mutazioni oncogeniche possono liberarsi dagli organi, diffondersi attraverso la circolazione e colonizzare organi distanti (Figura 1).
In primo luogo, gli autori hanno utilizzato un modello murino di cancro gastrico per dimostrare che una proteina del canale di perdita di sodio non selettiva (NALCN) è sovraregolata negli adenocarcinomi gastrici rispetto alle cellule staminali basali gastriche. L’analisi di oltre 10.000 genomi di tumori umani ha rivelato che le mutazioni NALCN non sinonime erano arricchite nei tumori gastrici e colorettali, indicando che il 75% di questi cambiamenti comprometterebbe la funzione del canale del sodio. Il knockdown di Nalcn (un analogo di NALCN) nei modelli murini di adenocarcinoma gastrico e pancreatico ha aumentato il numero di cellule tumorali circolanti e metastasi senza alterare il numero o la dimensione dei tumori primari e il profilo di espressione genica del tumore circolante della carenza di Nalcn ha rivelato firme simili a quelli delle unità tumorali circolanti ottenute dall’uomo. Questi risultati supportano un ruolo per NALCN nella soppressione della diffusione metastatica senza influenzare l’inizio del tumore.
Figura 1 Proliferazione di cellule epiteliali neoplastiche e non trasformate.
Sorprendentemente, il knockdown di NALCN nelle cellule che esprimono una proteina fluorescente ha anche provocato un aumento delle cellule non tumorali circolanti, con moduli fluorescenti e popolazioni carenti di Nalcn rilevate nei polmoni e nei reni dei topi più anziani. Le cellule non neoplastiche circolanti carenti di Nalcn iniettate per via endovenosa nei topi riceventi sono state in grado non solo di entrare e colonizzare il parenchima di più organi, ma anche di stabilire strutture morfologicamente normali all’interno degli organi riceventi, ad esempio glomeruli e tubuli renali nel rene.
Questi dati indicano che le cellule epiteliali possono proliferare attraverso turnover, seeding e differenziazione in risposta a segnali microambientali locali per colonizzare organi distanti in assenza di mutazioni driver oncogeniche, separando così il processo di metastasi dalla tumorigenesi. Il tumore metastatico carente di nalckin e le cellule non neoplastiche dei topi hanno profili trascrizionali simili a quelli dell’uomo; Tuttavia, per quanto riguarda la leadership della malignità, la ricerca non ha dimostrato un ruolo per le mutazioni NALCN non sinonime osservate nel sequenziamento clinico del tumore. L’estensione delle cellule epiteliali non trasformate nei pazienti non è nota. Anche i meccanismi mediante i quali il knockdown del NALCN consente la proliferazione epiteliale e la misura in cui le cellule epiteliali wild-type (non trasformate) possono metastatizzare il NALCN (possibilmente bloccando la funzione del NALCN) non sono chiari. Alcune analisi hanno dimostrato che le metastasi si verificano all’inizio della tumorigenesi, ma i dati attuali forniscono prove dirette in vivo della diffusione epiteliale anche in assenza di mutazioni oncogeniche. Separare l’inizio del tumore dalle metastasi ha importanti implicazioni per comprendere la progressione del tumore e possibilmente per lo sviluppo di future terapie antitumorali.
Molte terapie contro il cancro prendono di mira le mutazioni guida che danno inizio e perpetuano i tumori, ma i farmaci non elimineranno la proliferazione delle cellule non trasformate. Se si dimostrerà effettivamente che la loro proliferazione è una fonte di tumori secondari, allora saranno necessari nuovi approcci terapeutici. La diffusione iniziale e la diffusione di organi distanti da cellule epiteliali non trasformate, seguite dall’acquisizione posteriore di mutazioni oncogeniche, possono essere la base del fenomeno clinico del cancro metastatico del sito primario sconosciuto, che costituisce approssimativamente il 5% dei tumori in tutto il mondo. Questi di solito hanno un decorso sfavorevole che può essere spiegato da una diversa origine altamente flessibile e migratoria dello stato cellulare. Il profilo molecolare dei tumori nel sito del tumore primario sconosciuto è stato principalmente limitato alla sequenza di esoni di specifici geni correlati al cancro; Questo approccio ha prodotto poche prove sul loro comportamento clinico distinto. Studi futuri che cercano di identificare le mutazioni NALCN o altre alterazioni specifiche di un fenotipo di spargimento genereranno nuove strade terapeutiche tanto necessarie per questi tumori aggressivi.
È stato dimostrato che le cellule epiteliali normali hanno la capacità di migrare, in particolare nel contesto della guarigione delle ferite. Tale migrazione epiteliale e cambiamento di differenziazione si verificano all’interno di un letto epiteliale contiguo, ma si suggerisce che una più ampia proliferazione epiteliale attraverso la circolazione sia possibile e possa servire come meccanismo fisiologico per il reimpianto e la riparazione dei tessuti. In effetti, è stato dimostrato che la rigenerazione e la metastasi condividono programmi diversi dall’inizio del tumore primario. Molti tumori insorgono in caso di lesione e riparazione tissutale cronica, tra cui colite, retto, carcinoma epatocellulare, carcinoma a cellule squamose della testa e del collo e altri. L’acquisizione della mutazione oncogenica nelle cellule epiteliali rigeneranti porta a metastasi più velocemente della stessa mutazione nell’epitelio non rigenerante. Infatti, i tumori associati alla colite sono associati a una prognosi peggiore rispetto ai tumori del colon sporadici. A loro volta, questi dati indicano la necessità di terapie distinte per i tumori che insorgono in un contesto rigenerativo e di terapie profilattiche specifiche per le metastasi in pazienti con condizioni infiammatorie croniche per eliminare le cellule circolanti prima che acquisiscano le mutazioni oncogeniche. Al contrario, l’aumento dello spargimento epiteliale aumenterebbe l’efficacia delle terapie con cellule staminali sviluppate per promuovere la rigenerazione dei tessuti. Tuttavia, la fibrosi renale e cutanea è evidente nei vecchi topi carenti di NALCN, risultati che suggeriscono complesse interazioni tra attività elettrica epiteliale, programmi rigenerativi, invecchiamento e progressione del tumore; Questioni che meritano ulteriori approfondimenti. Lo studio del team di Rahrmann fornisce un quadro concettuale e molecolare per la pianificazione di esperimenti che valutano il modo in cui la proliferazione cellulare è correlata alla tumorigenesi e alla rigenerazione dei tessuti.
Fonte bibliografica
Disaccoppiamento delle metastasi dalla tumorigenesi
Karuna Ganesh, Ph.D., Ph.D.
Programma di Farmacologia Molecolare, Sloan Kettering Institute e Dipartimento di Medicina, Memorial Sloan Kettering Cancer Center, New York.
Engel G Med 2023; 388: 657-659

“Appassionato di musica. Amante dei social media. Specialista del web. Analista. Organizzatore. Pioniere dei viaggi.”